Стресс преследует нас постоянно: на работе, в семье, в самолёте, за рулём автомобиля. Но стресс бывает разный. Есть острый стресс — сильный и непродолжительный, воздействие которого на организм может быть полезным. А есть стресс хронический — несильный, но долгий, который только вредит здоровью. Считается, что хронический стресс заметно повышает вероятность таких серьёзных заболеваний, как гипертония, диабет, язва желудка и, конечно, рак. Так что, когда говорят, что все болезни «от нервов», это во многом правда. Но что за конкретный механизм связывает стресс и, к примеру, рак?
Нашему организму есть что противопоставить злокачественным клеткам. Остановить рост опухоли и её метастазирование мог бы иммунитет — борьба со злокачественными клетками входит в его обязанности. То есть оружие есть, но оно вынужденно бездействует, потому что у злокачественных клеток есть ряд особенностей, которые помогают им избежать внимания иммунной системы. Например, на опухолевых клетках практически нет рецепторов, с которыми могли бы взаимодействовать иммунные клетки и молекулы. Множество лабораторий по всему миру работают над тем, как активировать противораковые способности иммунитета — за исследования в этой области в 2018 году даже дали Нобелевскую премию*.
Однако иммунитет существует не сам по себе — он взаимодействует с другими системами органов и подчиняется общим процессам, которые происходят во всём организме. Один из таких общих процессов — старение.
К слову сказать, рак нередко называют болезнью старения. Если взять онкологические заболевания в целом, то их действительно чаще обнаруживают у пожилых людей, хотя есть такие разновидности онкозаболеваний, которые возникают преимущественно в молодом возрасте. Клетки опухоли — это клетки, которые с течением времени утратили свою зрелость, впали в детство, будучи е в состоянии осуществлять «взрослые» функции. Поэтому онкологические заболевания можно рассматривать как проявление старения.
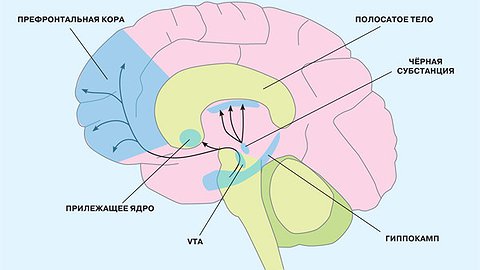
У старения, в свою очередь, есть много механизмов на разных уровнях — молекулярно-генетическом, клеточном, физиологическом. При этом центральный механизм старения заложен в дофаминовой системе мозга. Надо сказать, что дофаминовая система исключительно чувствительна к стрессам. И поскольку от неё зависит не только то, что происходит в мозге, но и на периферии, в других органах, мы предполагаем, что дофамин и использующие его нейроны играют важнейшую роль в механизмах, которые связывают стресс и появление злокачественных опухолей.
Дофамин и старение
Дофамин — это нейромедиатор, который нейроны используют для передачи электрохимических сигналов друг другу. Нейроны, синтезирующие дофамин, называют дофаминергическими. Дофамин имеет много функций. Он нужен нейронным сетям, от которых зависит уровень интеллекта, уровень двигательной активности. Также он необходим мозговым структурам, которые управляют мотивацией и обеспечивают нам хорошее настроение и жизнелюбие.
Некоторые из дофаминергических нейронов могут жить более 100 лет, но с возрастом дофаминергическая система всё же угасает, что приводит к ухудшению когнитивных (познавательных), мотивационных и двигательных функций. Дофаминергические нейроны считают главными маркерами старения, и вот почему. Около 80% таких нейронов находится в нигростриатной системе среднего мозга. В компактной зоне чёрной субстанции (Substantia nigra) находятся тела нейронов, а их отростки — в полосатом теле (стриатуме). Нигростриатная система управляет большей частью двигательных процессов. У молодых людей обнаруживают около 400 тысяч дофаминергических нейронов в чёрной субстанции, но к шестидесяти годам их число снижается до 250 тысяч. При болезни Паркинсона, которая обычно развивается с возрастом и связана с гибелью дофаминергических нейронов, их насчитывают от 60 до 120 тысяч. Число дофаминергических нейронов человека начиная с 45 лет уменьшается примерно на 10% за десятилетие. Пик потерь (40—50%) приходится примерно на 88—89 лет — те, кому повезло со здоровой старостью, нередко умирают в этом возрасте просто от старческой немощи. Однако у долгожителей, переваливших за 100 лет, число дофаминергических нейронов в дальнейшем уменьшается намного медленнее.
Дофамин как антидепрессант
Связь дофаминовой системы с депрессией подтверждается тем, что у пациентов с некоторыми видами депрессии уменьшается число дофаминергических нейронов. К тому же стимуляторы дофамина могут работать как антидепрессанты, что было выявлено и в клинических исследованиях.
Экспериментально показано, что стресс, вызванный разделением крыс-матерей и крыс-детёнышей, приводил к тому, что у крыс-матерей уменьшалось число нейронов в гиппокампе, одном из главных центров памяти. Однако при активации дофаминовых рецепторов нейронов гибло меньше. Материнская забота, когда крыса-мать усиленно вылизывает и всячески заботится о детёнышах, приводит к подавлению рецепторов гормонов стресса, что нормализует (в данном случае повышает) активность дофаминергических нейронов. Это снижает тревожность у взрослых крыс. Эксперименты на серых полёвках Microtus ochrogaster, для которых характерны моногамные семьи, показали, что дофамин укрепляет у них чувство привязанности к партнёру. Однако гиперактивированная дофаминергическая система вызывает поведенческие аномалии. Например, когда беременных мышей сажали на низкобелковую диету, у них рождались детёныши с гиперактивированной дофаминергической системой и изменённым неадекватным поведением. У человека повышенная активность дофаминергической системы способствует развитию психических расстройств, например шизофрении. В профилактике и терапии психических расстройств следует учитывать стрессорные факторы, которые могут как подавлять работу дофаминергической системы, так и приводить к её чрезмерной активации.
Как важная часть системы вознаграждения мозга дофамин помогает испытывать удовольствие (или удовлетворение) от каких-то действий. Дофамин естественным образом вырабатывается в больших количествах в ответ на положительный, по субъективному представлению человека, опыт: вкусную еду, секс или чувство удовлетворения от хорошо выполненной работы. Нейробиологические эксперименты показали, что даже счастливые воспоминания могут увеличить уровень дофамина. Поэтому дофамин нужен мозгу для оценки поведения и мотивации, он закрепляет в памяти действия, важные для выживания и продолжения рода. Комплексная регуляция сложного поведения, осуществляемая механизмами дофаминергической активности, связана в итоге с выживанием. Но если дофамина по какой-то причине вырабатывается мало, то не будет ни хорошего настроения, ни мотивации на дальнейшие успехи.
Дофамин как противоопухолевый агент
Дофамин есть не только в мозге: из мозга он по симпатической нервной системе транспортируется в другие органы и ткани. Следует отметить, что он синтезируется также и в желудочно-кишечном тракте. Запасается дофамин в тромбоцитах, которые служат главным циркулирующим резервуаром дофамина за пределами центральной нервной системы. Рецепторы к дофамину есть на клеточных мембранах сердца, почек, коры надпочечников, кровеносных сосудов, иммунных клеток.
Дофамин воздействует на опухоль, подавляя деление её клеток и развитие в ней сосудов. Вместе с тем выявлено, что дофамин продуцируется различными лимфоцитами и может играть роль в дифференцировке цитотоксических Т-клеток (то есть тех, которые уничтожают больные клетки, в том числе и злокачественные), контролировать их киллерную активность и участвовать в иммунном ответе против опухоли.
Если сравнить по уровню дофамина здоровые ткани и опухоли, то выясняется, что в злокачественных опухолях его меньше. В опухолевой ткани рака прямой кишки человека, например, уровень дофамина в 3—10 раз ниже по сравнению со здоровой тканью. Дофамина нет в злокачественной опухоли желудка человека, хотя в здоровой ткани он есть. У мышей, которым пересаживали костную саркому, концентрация дофамина в костном мозге уменьшалась в 7 раз.
Если у мышей с помощью нейротоксина убивали нейроны головного мозга, синтезирующие дофамин, то понижался его уровень и на периферии. У таких животных пересаженные меланомы и саркомы росли быстрее, имея бoльшую плотность опухолевых микрососудов и их проницаемость. Наоборот, если системный уровень дофамина у мышей был повышен, то после подкожной имплантации клеток мелкоклеточного рака лёгкого опухоли росли медленнее, с более низкой плотностью микрососудов в сравнении с контролем. В экспериментах с клетками рака яичников было показано, что воздействие дофамина снижает плотность микрососудов опухоли, агрессивность раковых клеток и заставляет их включать механизм апоптоза — программу самоуничтожения.
Оценить воздействие дофамина пытались и в клинических исследованиях. Так, у пациентов с меланомой удалось выявить, что при десятикратном повышении уровня дофамина в плазме крови раковые клетки начинают делиться на порядок медленнее. Однако исследование пришлось остановить после первого же цикла внутривенного введения дофамина из-за тяжёлых сердечно-сосудистых побочных эффектов.
По всей видимости, противоопухолевые эффекты дофамина обусловлены тем, что он участвует в работе иммунитета. Органы иммунной системы богато иннервированы симпатическими нервами, содержащими большие количества дофамина. На иммунных клетках есть рецепторы к дофамину. Всё это говорит о том, что дофамин в иммунитете играет не последнюю роль.
Действительно, если уменьшить число мозговых нейронов, синтезирующих дофамин, то из-за сниженного уровня дофамина будут хуже размножаться лимфоциты и хуже созревать цитотоксические Т-лимфоциты. При этом они в меньшей степени будут взаимодействовать с раковыми клетками, что делает минимальной, если не сказать нулевой, их киллерную активность в отношении опухолевых клеток. Как следствие, опухоль получает дополнительный шанс. Поэтому, например, в экспериментах с истощением дофаминовой системы можно видеть, как одновременно усиливается опухолевый рост и повышается уровень белков, которые стимулируют рост опухоли.
Как всё связано? Попробуем выстроить единую картину. Иммунная система обязана бороться со злокачественными клетками, и в этом ей может помогать дофамин, чьи противоопухолевые свойства широко продемонстрированы. Но дофамин, которым располагает иммунная система, напрямую зависит от дофамина в мозге. Потеря дофаминергических нейронов мозга приводит к тому, что дофамина становится меньше и в клетках иммунитета в периферическом организме.
Но почему же дофаминергических нейронов становится меньше? Например, из-за возраста. И не только. Нейроны губит затяжной, хронический стресс. Потому-то мы и можем называть рак болезнью «от нервов». Как можно избавиться от стресса — это тема для отдельного разговора. Но, вообще говоря, физическая активность, интеллектуальная деятельность, диетические ограничения и жизнелюбие помогают справиться со стрессом, замедляют угасание дофаминергической системы, а значит и старение со всеми его последствиями.
Основные функции дофамина
Нейромедиаторные:
● Обеспечивает двигательную активность
● Способствует когнитивной деятельности
● Действует как антидепрессант
Противоопухолевые:
● Способствует дифференцировке цитотоксических лимфоцитов
● Обеспечивает адгезию эффекторов иммунитета с опухолевыми клетками
● Способствует лизису опухолевых клеток
Ссылки на научные исследования, упоминаемые в статье, приведены в следующих обзорах:
Бочарова О. А. Адгезионная концепция в биологии злокачественного роста // Патологическая физиология и экспериментальная терапия, 2014; (2): 87—93.
Бочарова О. А., Бочаров Е. В., Кучеряну В. Г., Карпова Р. В. Дофаминергическая система: стресс, депрессия, рак (часть 1) // Российский биотерапевтический журнал, 2019, т. 18, № 3. С. 6—14.
Бочарова О. А., Бочаров Е. В., Кучеряну В. Г., Карпова Р. В. Дофаминергическая система: стресс, депрессия, рак (часть 2) // Российский биотерапевтический журнал, 2019, т. 18, № 4. С. 25—33.
Комментарии к статье
*См. статью: Стасевич К. Иммунное оружие против рака, «Наука и жизнь» № 11, 2018 г.